扫频光学相干断层成像技术及其在眼科的应用 |
您所在的位置:网站首页 › oct octa › 扫频光学相干断层成像技术及其在眼科的应用 |
扫频光学相干断层成像技术及其在眼科的应用
|
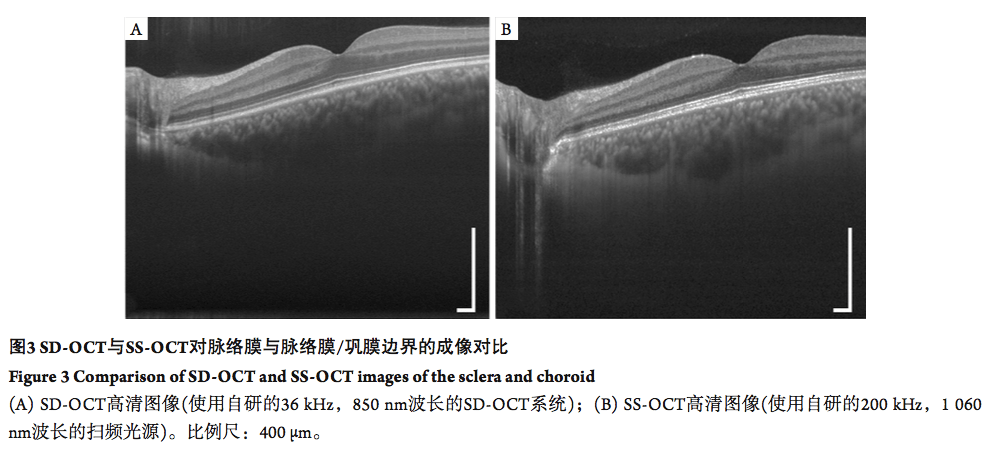
1.2 OCT 系统的灵敏度衰减与纵向成像深度 受限于光谱仪的设计,在S SD-OCT采集单个波长信号时,会受到光学衍射极限以及相机阵元对区域积分探测的影响,其系统灵敏度会随着成像深度的增加而发生衰减。在 SS-OCT中,其灵敏度衰减则主要与光源本身的瞬时谱宽( 线宽) 有关,光源瞬时出射的光谱越窄,瞬时相干性越好,灵敏度随着深度衰减也相对越小。目前眼科成像中,通过合理的激光器设计,SS-OCT系统的灵敏度能够在10~50 mm的成像深度范围内做到衰减极低。 SD-OCT的成像深度由系统探测到的中心波长λ0(并非光源的中心波长),系统能够探测到的波长范围Δλ( 并非光源的波长范围),及系统对Δλ的采样点数N 决定[7]。SD-OCT系统中,λ0与Δλ由光谱仪的光学设计(包括光栅线数、相机镜头焦距、相机线阵宽度) 决定,N 则由线阵相机的像素数量决定,完成设计并确定元件后其探测量程一般无法修改。而对于SS-OCT,在光源每个扫频周期的光谱带宽不变时,Δλ和N则可以通过改变采集卡的采样率与采样点数去调整。因此,SS-OCT可以灵活的实现成像深度的改变。另一方面,部分扫频光源也可以改变扫频周期内的光谱带宽,从而影响系统的Δλ,实现探测量程的改变[8-9]。 基于低灵敏度衰减与更大的纵向成像范围, SS-OCT系统将可以获得相较现有SD- OCT系统更大的成像深度,将能够给对眼前节成像、大范围眼底成像、眼轴长成像提供便利与可行性。 1.3 OCT 系统的光源波长 OCT系统的轴向分辨率由光源的中心波长与光源带宽决定。目前扫频光源的波长主要集中在1 060 , 1 310 , 1 500 nm波段[10],因为这几个波长的元件工艺成熟,价格相对低廉而且处于生物成像窗口。人眼后节成像的SS-OCT系统常采用1 060 nm波段,这是因为1 060 nm波段的光在人眼中的衰减较小, 且能够提供相对更好的分辨率。≥ 1 310 nm的波长的光会被人眼中大量存在的水分子所吸收[11],导致成像的信噪降低[12],所以不能用于眼底视网膜成像。然而1 310 nm光波具有很高的生物组织穿透特性,可用于眼前节成像,并已展现了良好的成像结果[13]。 相对于850 nm的眼底SD-OCT 系统, SS-OCT成像系统由于利用了更长的1 060 nm光源波长获得了针对深层组织的良好层析能力,可以更容易地穿透眼底,实现对脉络膜和巩膜组织信息的展示。 1.4 OCT 系统的成像速度 成像速度是 OCT尤其 OCT血流成像( OCTangiography,OCTA)中最受关注的参数之一。目前,SD-OCT中采集速度受到线阵相机的速度的限制,目前能够达到数十万线每秒的采集速度 [14]。 SS-OCT则是通过光源的设计来提升扫频速度。目前已有研究演示利用1.6 MHz的 SS-OCT实现大视场(约80°)眼底三维体成像 [14]。可以预见的是, SS-OCT系统在未来能够低成本的实现每秒数个三维体积的扫描。 SS-OCT系统能够提供极高的成像速度,在临床上能更方便地获取大视场眼底断层图像与大视场眼底OCTA图像,为眼底外周区域的诊断提供准确有效的途径。 2 SS-OCT在眼科的应用 2.1 深层视网膜增强成像 视网膜成像是眼科 OCT成像的重要应用之一。相对于850 nm,1 060 nm具有更好的组织穿透性,可以实现对深层次视网膜的成像(如脉络膜和巩膜)。如图3所示,1 060 nm的 SS-OCT系统相对850 nm的SD-OCT系统更有利于巩膜成像。
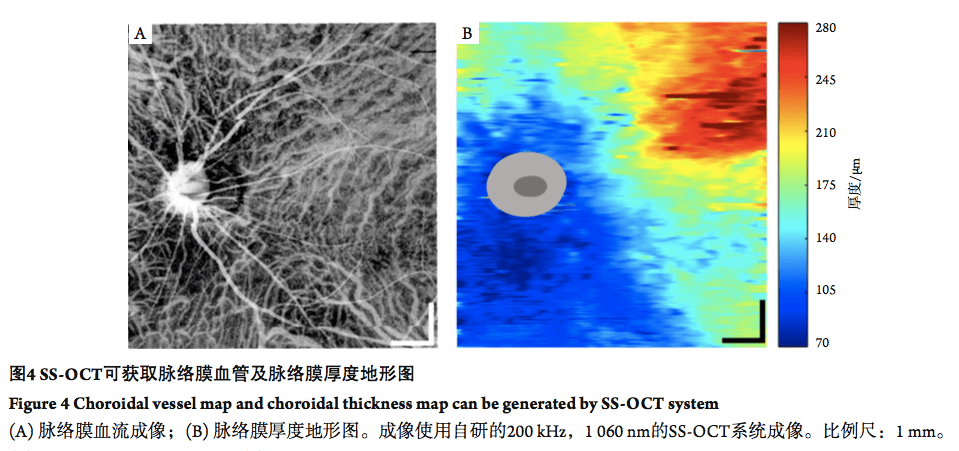
研究[15]发现:使用SS-OCT可以获得更好的脉络膜图像,且成像一致性也有显著提升。SS-OCT能更有效对脉络膜成像,分离包括脉络膜上间隙在内的脉络膜-巩膜连接部,而这些层次在传统的SD-OCT成像里则较难被区分[16]。 SD-OCT对深层组织的成像时信噪比相对不足,需要通过多次平均的增强模式提高信噪比,因此一般仅能提供较少帧数脉络膜图像,而较难实现对脉络膜的三维成像。SS-OCT在可以轻松地实现对脉络膜与巩膜三维成像,获得脉络膜厚度地形图 (图4)。利用SS-OCT,已有诸多文献[17-18]报道了脉络膜厚度变薄与老年黄斑变性(age-related macular degeneration,AMD)发展程度的关联。同时也有部分研究者使用SS-OCT系统证明了中心性浆液性脉络膜视网膜病变中(central serous chorioretinopathy,CSC)脉络膜厚度的显著增加[19]。同时,巩膜可视化程度在SS-OCT成像中也得到了提升,这使研究者能够深入了解巩膜的病变过程[20-21],如病理性近视下的巩膜变化规律[22]。
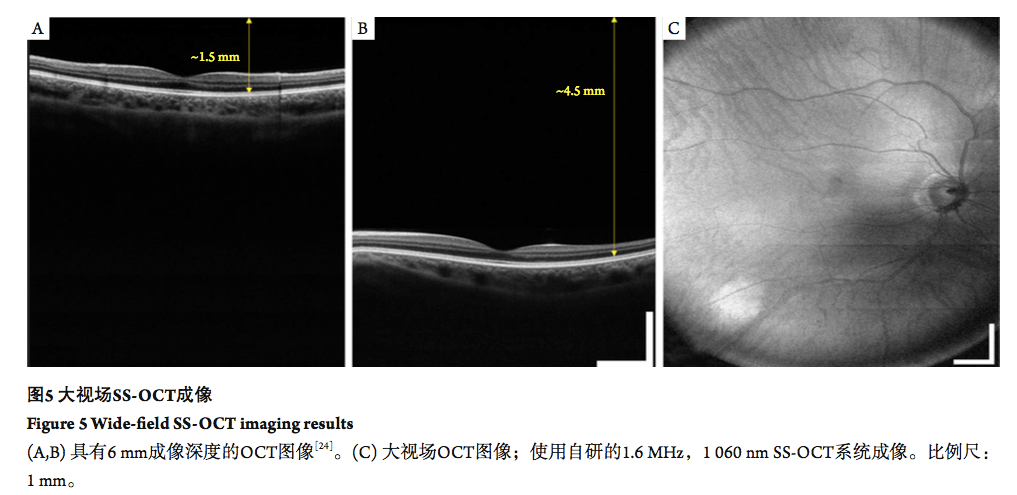
2.2 更大视场的眼底成像 SS-OCT的成像速度相较SD-OCT显著提高, 其能在短时间内实现大范围的数据采集。在目前的商业SD-OCT系统中,受限于成像深度与成像速度,单次三维采集一般限制在6~9 mm成像范围内。虽然采用多次采集再拼接的方式也可实现对更大视场的成像,但会延长成像时长,导致其在临床应用上较难普及,另外三维配准的复杂性也加大了方法的实现难度[23]。相对SD-OCT,SS-OCT系统在成像深度与成像速度方面都显著提升。成像深度方面,SS-OCT可获取更深层的信息(图5A,B),以更好地适应眼球弧度造成的深度差异[24]。成像速度方面,目前基于SS-OCT系统在眼底成像中可以实现高达1.6 MHz的速度,比商用SD-OCT系统提升约10倍,能一次采集80~100°的眼底图像[14]。
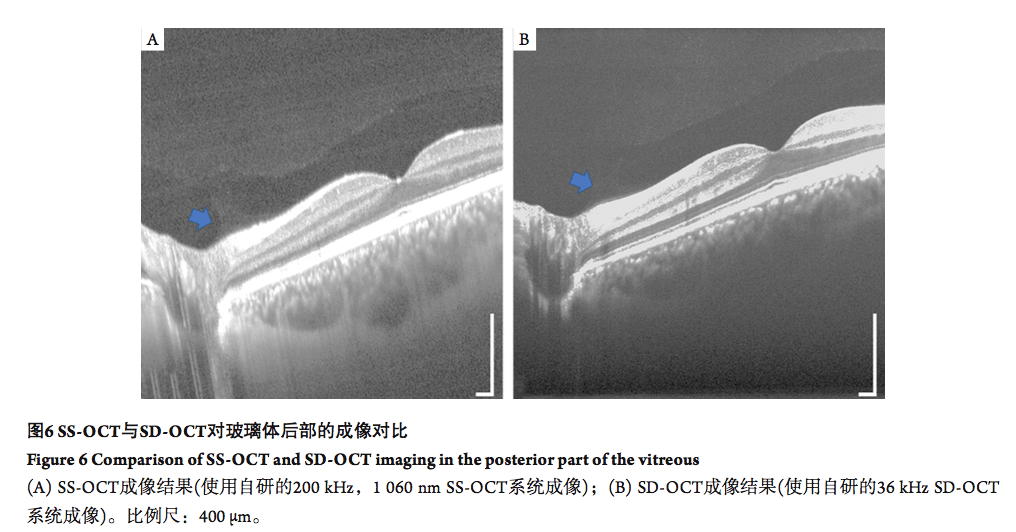
基于SS-OCT的大视场OCT已经被用于早产儿视网膜病变(retinopathy of prematurity,ROP)的诊断中,其结果可以更客观地反映无血管区边界处的结构变化[25],并更准确地推断疾病的严重程度[26]。针对糖尿病视网膜病变的诊断(diabetic retinopathy, DR),研究[27-28]表明:大视场OCT对新生血管的早期发现起重要作用;也有回顾性研究[27]利用荧光造影成像验证了大视场SS-OCT在检测增生性视网膜糖尿病视网膜病变(proliferative diabetic retinopathy, PDR)新生血管的有效性。 高速的 SS-OCT能够在短时间内实现大范围OCT成像(图5C)。研究 [29]表明采用SS-OCT能够对AMD 患者的视网膜微血管进行诊断与随访。在息肉状脉络膜血管病变( polypoidal choroidal vasculopathy,PCV)的相关研究中。研究[30]发现:SS-OCT成像能显示脉络膜内的血管异常,而这在以往仅能通过荧光造影实现。 在青光眼诊断中,相比于传统SD-OCT需要分3 次扫描黄斑、视盘和乳头周围神经纤维层, SS-OCT利用其高速大视场成像优势,在1次扫描中就可得到这3部分的结构信息和血流信息,这些大视场扫描的图像对于判断视网膜神经纤维层缺损范围、确定缺损是否延伸到黄斑,以及乳头和黄斑周围的血管密度降低情况等细节可视化过程中起到重要作用[31-32]。 玻璃体后脱离经常发生在近视、白内障、青光眼等视力受损疾病的早期,所以对玻璃体进行三维成像至关重要。如图6 所示, SS-OCT更深的成像深度,低灵敏度衰减与高信噪比等特性使其相对SD-OCT更适合采集玻璃体后部的图像。有研究使用SS-OCT获得了玻璃体后侧高清晰图像[33],并展示了后玻璃体的OCT解剖图像[34]。回顾性研究[29]利用SS-OCT成像比较了玻璃体黄斑牵引(vitreomacular traction, VT) 和黄斑裂孔( macular hole,MH) 患者的疾病分期情形。同时,研究[35-36]证明了SS-OCT能够有效展示后部前皮质玻璃体囊袋( posterior precortical vitreous pocket, PPVP) 结构,为揭示其生理功能奠定了一定的基础。
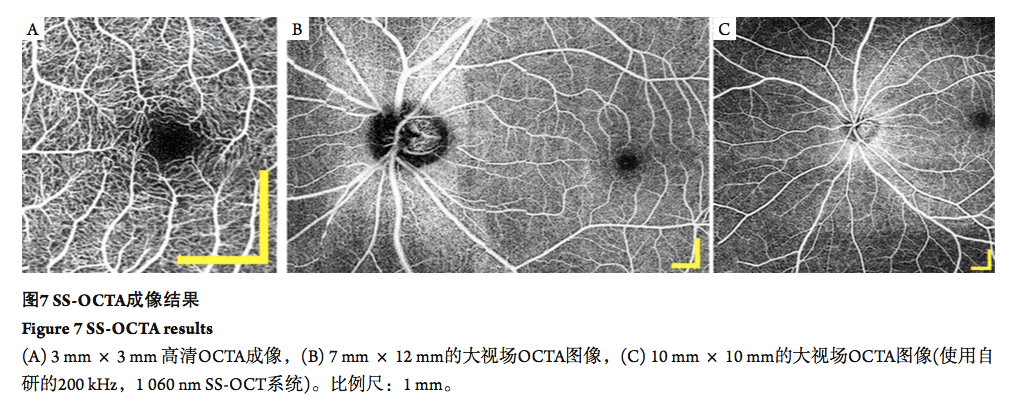
2.3 OCT 血流成像 伴随着OCT成像速度的提升, OCTA技术也开始更多的应用到了临床,通过对同一位置的重复扫描获得多张 OCT断层图像, 再对断层数据进行数值计算得到血管的位置信息。SS- OCT的高速优势使其可以在大范围内实现高清OCTA成像 [37]。 此外, SS-OCT可以更好地获取脉络膜毛细血管层的 OCTA成像结果 [38],并检测脉络膜毛细血管层的新生血管,从而对早期AMD实现诊断[39] 。2017 年,一项基于OCTA的研究[40]表明:在视网膜色素上皮层(retinal pigment epithelium,RPE) 以下的成像中, SS-OCTA比SD-OCTA具有优势,能更好地显示出黄斑病变中的新生血管。 高速 SS-OCT可以实现短时间内的大视场 OCTA成像。图7展示了利用 SS-OCT获得的3 mm × 3 mm,7 mm × 12 mm 及 10 mm × 10 mm 的OCTA成像结果。目前已经有诸多研究展示了大范围眼底成像 [41]。因此SS-OCTA在对糖网或其他存在周边区域血管病变的疾病的早期检测中起重要作用[27]。SS-OCT可以准确定位糖网病血管的增生性改变,并监测新生血管的发展。利用 SS-OCT对新生血管的血流和结构特征变化的进行连续评估和监测将可指导治疗策略 [42]。
2.4 前节成像 前节OCT(anterior segment OCT, AS-OCT) 是OCT成像在眼科的重要应用之一。SS-OCT具有较大的成像深度,因而更适合于眼前节的成像和分析。SS-OCT已经实现对角膜、前房、虹膜和晶状体等结构的高清成像[43-44],这些结果将广泛应用于眼科临床相关参数的评估,如角膜地形图、角膜层析成像、前段分析、生物测量及许多其他可能的临床应用中[45]。 商用 SD-OCT系统的成像深度是2~3 mm, 而人体眼前房深度约为5 mm 。相较眼底成像而言,眼前房成像对成像深度的要求也更高。虽然SD-OCT也可通过特殊方法实现成像深度的倍增, 从而获得包括晶状体在内的整个眼前节图像 [46],但这些特殊方法很难在实际临床应用中使用。 SS-OCT能够容易的实现对整个眼前节的成像 ( 图8)[24]。同时,有研究[47]使用SS-OCT对前节进行360° 放射状扫描成像,并实现对原发性开角型青光眼患者、瞳孔扩张后角度闭合患者虹膜体积的研究。利用高速SS-OCT能够建立密集准确的角膜地形图,可以用于评价包括角膜上皮在内的角膜结构[48-49],这将为激光近视手术这类需要角膜的准确定量的提供极大的便利。此外,角膜弹性研究和眼压测量也越来越多通过SS-OCT去实现,因为速度优势和灵敏度优势使其更能够大幅降低眼动干扰和实现深层成像[48,50]。
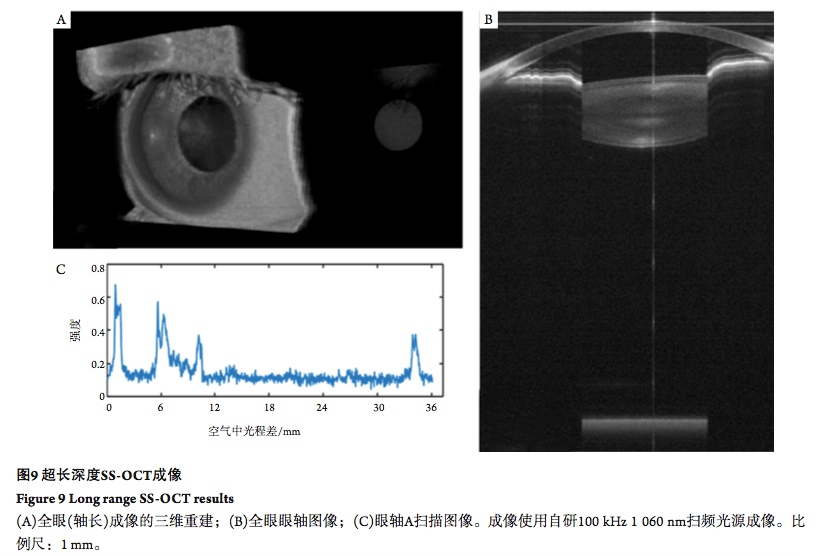
2.5 眼轴成像 最近的扫频光源技术发展取得了长足的进步,已有研究[51]利用 SS-OCT实现超快的成像速度 [52]和超长的成像深度(米级别)。图9展示了本课题组利用自主研发的SS-OCT对人眼成像的结果, 表明了 SS-OCT可以应用在眼轴长的精确测量及人工晶体参数计算中 [53]。凭借这些崭新的技术及SS-OCT采样的灵活性,可以实现全眼的三维OCT 成像[54-55]。在 SS-OCT普及之前,白内障术前测量一方面是通过生物测量仪测量角膜厚度、前房深 度、晶状体厚度及眼轴长度等信息用于评估视力和选取植入晶体参数,但是目前商用技术是基于速度较慢的TD-OCT或SD-OCT的生物测量仪,测量过程相对复杂,测量精度有待提高。另一方面是利用Scheimpflug成像技术或眼前节SD-OCT测量晶状体的结构信息,但是这两个技术不能穿透整个晶体,其对晶状体的分析主要基于晶状体的前极。SS-OCT利用其超大成像深度的特性,可以在数秒内完成整个眼前节结构成像和眼轴长信息的提取,为医生提供了参数更全,速度更快,分辨率更高的眼球内部结构信息,并能更好地检测小的晶状体浑浊[56]。
2.6 诊疗中的新应用与改变 SS-OCT与 SD-OCT均采用频域 OCT成像原理,二者成像的结果具备极高的一致性。总体来说,SS-OCT可以产生更大的扫描范围,探索视网膜更大的区域。更深的组织渗透与更好的成像脉络膜和其他更深的结构,改善可视化的媒体阴影和更高的图像对比度。 上文已分别介绍了 SS-OCT系统相对SD-OCT系统的优势,并展示了基于这些优势所展开的应用研究。针对临床,这些新应用可以大致分类为:1) 可以更好地进行玻璃体可视化,有助于加深对如玻璃体黄斑牵引、黄斑裂孔、后部前皮质玻璃体囊袋等疾病的病因研究;2) 可以更好地进行眼底外周视野OCT与OCTA成像的可视化,包括应用于早产儿视网膜病变,黄斑病变中的新生血管、青光眼、糖尿病视网膜病变外周新生血管的诊断;3) 提升脉络膜与巩膜的可视化程度,有助于加深巩膜的病变过程,及脉络膜与其他眼底 疾病的关联性研究;4) 提升前节成像的成像速度与成像深度,可以用于角膜弹性研究、眼轴长测量、晶体分析、白内障术前术后测量。 目前SS-OCT已经在多个应用中展示了其独有的特性,能够协助诊疗以往SD-OCT很难判断的疾病,且有希望在未来进一步得到拓展。 3 总结 SS-OCT能够对眼前节,后节及全眼进行高质量的成像;其更低的深度方向灵敏度衰减与更快扫描速度使其能够在短时间内对更大的范围进行成像;更长的深度成像范围使其能够更好地获取整个眼前节与眼轴长图像;更长的波长也使其在深层次组织成像上具备优势。尽管SS-OCT从多方面展现出优于SD-OCT与TD-OCT的能力,但是目前能够提供商业化的SS-OCT系统的公司依然相对较少。医院里目前使用的SS-OCT产品普遍也就是100~200 kHz的成像速度,因此,高性能的SS-OCT 将会赢得医生的欢迎。但是较一般SD-OCT而言更高的开发成本是限制现阶段SS-OCT普及的主要原因之一[5]。尽管存在一定的挑战,其独特的优势也逐渐受到临床及认可。随着技术的进步以及成本的降低,SS-OCT系统会在不远的将来获得临床的普及。 参考文献 资讯 j.01.2021.02.14.03 点击返回搜狐,查看更多 |
【本文地址】